生命学院合作揭示Hsp90分子机器调控PINK1的分子机制
新清华 2025年12月12日 第2386期 学术前沿
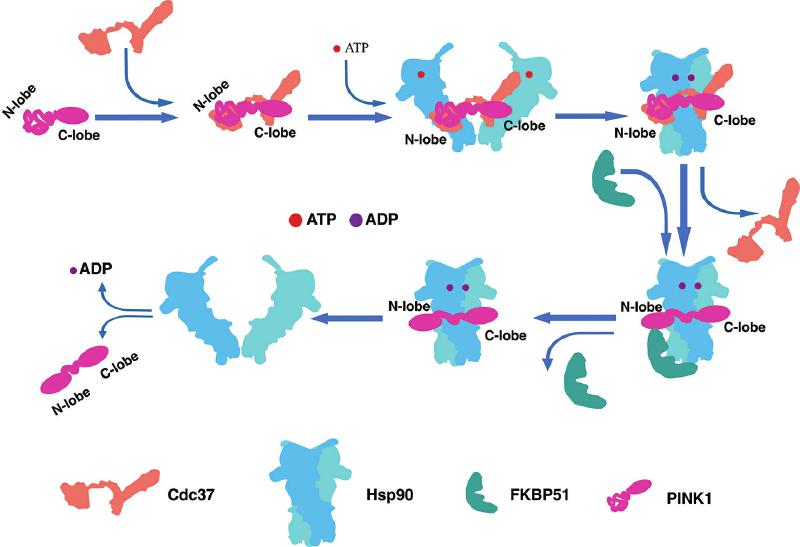
Hsp90机器调控PINK1的模式图。
本报讯 帕金森症病因复杂,遗传因素在其中扮演重要角色。近年来多项研究鉴定出与帕金森症相关的若干基因,其中蛋白激酶PINK1尤为关键。
近日,清华大学生命学院隋森芳院士团队与天津大学药物科学与技术学院梅坤荣教授团队合作在《自然·通讯》(Nature Communications)期刊上在线发表题为“Hsp90机器调控PINK1的分子机制”的论文,报道了PINK1与热休克蛋白Hsp90及其辅因子细胞分裂周期蛋白CDC37、肽基脯氨酰顺反异构酶FKBP51形成的多种复合物结构,为深入理解Hsp90分子伴侣调控激酶的作用机制提供了重要依据。
研究团队通过在293F细胞中过表达人源胞质PINK1,成功获得了其与内源Hsp90、CDC37、FKBP51结合的蛋白复合物,并进一步解析了三种复合物结构:Hsp90-Cdc37-PINK1复合物、Hsp90-FKBP51-PINK1复合物以及Hsp90- PINK1复合物。
研究首次发现FKBP51能够调控PINK1,形成PINK1处于N端折叠状态的Hsp90-FKBP51-PINK1复合物。同时,该研究首次捕获到PINK1的N端折叠完成、仅与Hsp90结合而不含其他辅因子的二元复合物Hsp90-PINK1的结构。
结构分析发现,在解析的三种结构中,内源的Hsp90均结合有二磷酸腺苷(ADP),表明闭合构象的Hsp90二聚体形成过程伴随三磷酸腺苷(ATP)的消耗。进一步生化实验发现,Hsp90及其辅因子对PINK1的调控发生在PINK1定位至线粒体、经线粒体外膜转位酶(TOM)复合物转运、N端被切除并释放到细胞质之后。值得注意的是,释放到细胞质中的PINK1具有催化活性。通过深入的结构与功能分析,研究团队提出了Hsp90机器调控PINK1成熟的分子模型。
该研究揭示了PINK1蛋白成熟过程的全新调控机制,并补全了Hsp90分子机器在激酶折叠途径中的关键环节,不仅深化了对Hsp90工作机制的理解,也为帕金森症的靶向药物研发提供了新的理论依据。
隋森芳和梅坤荣为该论文的共同通讯作者,清华大学生命学院博士后田旭阳、苏家跃(已出站)为共同第一作者。
(生命学院)