生命学院揭示去甲肾上腺素转运蛋白再摄取与抑制的分子基础
新清华 2024年08月23日 第2334期 学术前沿
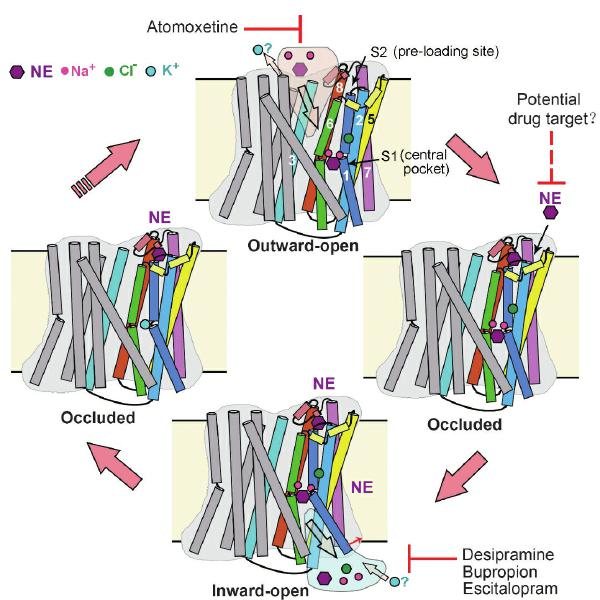
去甲肾上腺素转运蛋白(NET)的交替开放转运模型和抑制机制。
本报讯 去甲肾上腺素(NE)、多巴胺(DA)和血清素(5-HT)是重要的单胺类神经递质,影响着包括运动、激素分泌、奖惩和情绪相关的复杂行为和生理过程。这些神经递质在突触前膜去极化后释放到突触间隙,随后激活突触后膜上的受体并触发影响神经元兴奋性、突触可塑性和各种生理过程的细胞内信号级联。通过突触前神经元或者神经胶质细胞质膜上的单胺类神经递质转运蛋白(MATs),可以将单胺类神经递质再摄取回突触前膜,从而终止其对下游受体的激活状态。目前,MATs家族抑制剂主要在医药市场上用作抗抑郁药,可根据其化学结构和作用方式分为不同的类别。
近年来对MATs中底物转运及抗抑郁药物调节机制的研究进展迅速,其中果蝇多巴胺转运蛋白dDAT和人源血清素转运蛋白SERT的不同构象以及与多种抗抑郁药物分子结合的结构已经得到解析。但关于人源去甲肾上腺素转运蛋白(NET)的结构研究相对进展缓慢,这大大阻碍了抗抑郁药物的进一步优化和开发。
近日,清华大学生命学院、北京生物结构前沿研究中心闫创业副教授、袁亚飞助理研究员团队在《自然》(Nature)期刊上发表了题为“人类去甲肾上腺素转运蛋白再摄取与抑制分子基础”的研究论文,通过结构生物学和生物化学方法阐明了NET转运底物NE和DA的机制,首次报道了NET中的第二个底物结合位点和神经递质钠同向转运蛋白(NSS)家族的钾离子结合位点,揭示了四种不同类别的常用上市抗抑郁药物的选择性抑制机制,为进一步开发靶向MATs的药物奠定了基础。
研究团队利用冷冻电镜技术成功解析了人源NET蛋白的八个高分辨率结构,包括天然状态、结合底物(NE、DA)和四种常用上市抗抑郁药物(托莫西汀、地昔帕明、艾司西酞普兰、安非他酮)的结合状态。这些结构是天然蛋白在未使用任何基准标记或突变的情况下获得,分辨率在2.5到3.5埃之间。
深入了解不同抗抑郁药物对MATs的选择性抑制的分子基础对于抗抑郁药物的开发和应用具有重要意义。该研究通过解析四种不同类型的抗抑郁药物的高分辨率结构,为理解其对NET、DAT和SERT选择性提供了分子基础。研究进一步揭示了托莫西汀的竞争性抑制及其他三种抑制剂的混合型抑制机制与结合不同构象相关。这些研究为理解靶向MATs的抗抑郁药物选择性提供了重要见解,MATs抗抑郁药独特的结合模式和多靶点特性值得制药行业特别关注。
闫创业和袁亚飞为该论文的共同通讯作者,生命学院2019级博士毕业生谭佳鑫、2021级博士生肖媛和孔方为共同第一作者。(生命学院)